国产药:靶向发力补创新短板
审评审批时间缩短,研发动力不断增强 国产药:靶向发力补创新短板 经济日报·中国经济网记者 曾诗阳
与发达国家相比,我国药品研发水平仍有较大差距,跟随性研发较多,突破性创新相对缺乏。对此,我国出台一系列政策,深化审评审批制度改革,净化临床试验生态环境,加强创新药专利保护,整体推动从仿制药大国大步走向创新药大国。
刚刚过去的11月,国产创新药领域捷报频传。
11月2日,国家药品监督管理局有条件批准甘露特钠胶囊(GV-971)上市,用于治疗轻度至中度阿尔茨海默病;11月14日,百济神州公司研发的BTK抑制剂泽布替尼通过美国食品药品监督管理局(FDA)批准,适用于经治的成年套细胞淋巴瘤患者;11月26日,豪森药业甲磺酸氟马替尼获批上市,为慢性髓性白血病患者提供新的用药选择。
这3种药品,均为我国自主研发并拥有自主知识产权的创新药,其中,泽布替尼更是首款获得FDA“突破性疗法”身份认定、“优先审评”资格的中国“土生土长”的抗癌药,实现了国产创新药出海的新突破。
研发制约因素多
从最初立项到正式在FDA获准上市,泽布替尼的研发时长超过7年。就新药创制而言,这个时间并不算长。药品创新领域常有“双十定律”的说法:10年时间、10亿美元,是一款新药从早期研发到商业化平均所需的周期和成本。
就药品本身来说,新药研发是一场长征,需要历经靶点确认、化合物筛选、临床前研究、临床试验、新药上市、上市后监测等诸多环节;就制药企业来说,新药研发是一场赌博,周期长、成本高、风险大,有可能一战成名,也有可能满盘皆输。
以百济神州公司为例,其11月12日公布的第三季度财务业绩显示,第三季度公司收入为5014万美元,支出费用为3.62亿美元,其中包括研发费用2.37亿美元,净亏损超过3亿美元。在此情况下,在美获批上市的泽布替尼意义重大,或将扭转局势。
然而,并非所有制药企业都有百济神州的勇气。受经济实力有限、基础研究薄弱、人才储备不足和相关体制机制不完善等诸多因素制约,国内制药企业基本以生产仿制药为主,研发意识和能力均显薄弱,外资制药企业原研产品长期在我国药品市场独占鳌头。
政策红利正释放
转折出现于2015年国家启动药品审评审批制度改革。2015年,国务院印发《关于改革药品医疗器械审评审批制度的意见》,拉开了我国药审改革的序幕。
“改革之前,药审速度太慢了。以申报临床试验为例,一期临床需要排队一年,二期临床又得排队一年甚至一年半,二期排完还得排三期。改革之后,一到三期可以连批,临床试验也由审批制改为默示许可制,即临床试验申请受理60天之内,如果审批部门没有提出否定或质疑意见,就视为许可。”在中国医药创新促进会会长宋瑞霖看来,解决注册申请积压、提高审评审批质量和透明度、实施药品上市许可持有人制度等政策击中了药品创新的“靶点”,在中国医药创新史上具有里程碑意义。
大幕拉开,药审改革好戏一一登台,从《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》《接受药品境外临床试验数据的技术指导原则》等文件的陆续出台,到临床试验生态环境的净化,再到创新药专利保护的加强,政策红利不断释放,药品创新迎来了空前的机遇。
从国家药监局药品审评中心发布的一组数据,可以看出相关举措成效显著。
2016年,药审中心完成审评的注册申请共12068件,较2015年提高26%,排队等待审评的注册申请由2015年9月高峰期的近22000件降至近8200件;2017年,排队注册申请降至4000件,基本解决了药品注册申请积压问题;到2018年底,排队注册申请降至3440件,各类注册申请按时限审评审批率超过90%。
创新积极性提高
审评审批速度的连年提升给行业带来了众多利好。
“在过去,创新药有20年的专利保护期,但是新药从批准临床到真正上市有时需要花去十几年,留给企业的回报期只有短短几年。我们投入了巨大的时间和经济成本去做一款新药,但其回报甚至不如生产仿制药。审批提速,意味着留给我们的回报期变长了。”恒瑞医药董事长孙飘扬表示,审评审批时间缩短,新药就能加速上市,企业就能尽快见到收益并投入下一轮研发,这既能提高企业的研发动力和实力,又能满足患者的用药需求,形成药品市场的良性循环。
从市场角度来看,随着一致性评价的实施、医保目录的更新和带量采购的全国扩围,仿制药盈利空间被大幅压缩,创新药将成为药企的战略方向和成长驱动力,一批由专家领衔的研发型中小型药企快速发展,恒瑞医药、正大天晴、复星医药、石药集团等传统龙头药企也已经提早布局创新药研发,以恒瑞医药为例,其2018年累计投入的研发资金达26.7亿元,占销售收入的比重超过15%。
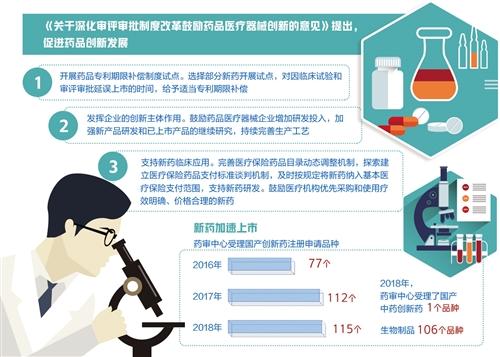
根据药审中心每年发布的药品审评报告,2016年,药审中心受理国产创新药注册申请77个品种,2017年上升至112个品种,2018年再涨3个品种,数量达到115个。除了115个品种的国产创新药,药审中心同年还受理了国产中药创新药1个品种、生物制品106个品种。与2017年相比,2018年受理的1类创新药新药临床试验(IND)申请增长了15%,新药上市申请(NDA)增长了150%。申请数量的变化,充分反映出我国各类主体创新积极性正在逐年提高。
在政策鼓励和市场推动的共同作用下,中国已经迈入了从仿制药大国走向创新药大国的坚实步伐。但与发达国家相比,我国药品研发水平和质量仍有较大差距,跟随性研发较多,突破性创新相对缺乏。国家药监局局长焦红表示,药品监管部门将以临床价值为导向,持续深化审评审批制度改革,让创新者受到激励、让创新者获得回报,推动我国由制药大国向制药强国迈进。
郑重声明:此文内容为本网站转载企业宣传资讯,目的在于传播更多信息,与本站立场无关。仅供读者参考,并请自行核实相关内容。



